আজকে আমরা আলোচনা করব একটি খুবই গুরুত্বপূর্ণ বিষয় সম্পর্কে - আইসোটোপ। আইসোটোপ বলতে এমন পরমাণুকে বোঝায় যারা একই পরমাণবিক সংখ্যা কিন্তু ভিন্ন ভর সংখ্যা বহন করে। একই তত্ত্বের পরমাণুগুলো যদি ভিন্ন সংখ্যক নিউট্রন ধারণ করে তাহলে সেগুলো আলাদা আইসোটোপ হিসেবে পরিচিত।
পর্যায় সারণিতে মৌলসমূহকে পারমাণবিক সংখ্যার ভিত্তিতে স্থান দেয়া হয় বলে কোন মৌলের আইসোটোপসমূহও পর্যায় সারণির একই স্থানে অবস্থান নেয়। বস্তুত: Isotope একটি গ্রীক শব্দ 'Iso' মানে 'একই' এবং 'tope' অর্থাৎ স্থান।
আইসোটোপগুলোর রাসায়নিক বৈশিষ্ট্য এক হলেও তাদের ভৌতিক বৈশিষ্ট্য পরস্পর ভিন্ন থাকে। আজকের আমাদের আলোচনায় আমরা আইসোটোপ সম্পর্কে বিস্তারিত জেনে নেব। আশা করি এই পোস্ট আপনাদের উপকারী হবে।
মৌলের পারমাণবিক সংখ্যা (Z.) মৌলের প্রোটন এবং ইলেকট্রন সংখ্যা নির্দেশ করে। পরমাণুর ভর সংখ্যা (A) থেকে পারমাণবিক সংখ্যা (Z) বিয়োগ করা হলে পরমাণুর নিউট্রন সংখ্যা পাওয়া যায়। কোন মৌলের একাধিক পরমাণু যাদের পারমাণবিক সংখ্যা এক কিন্তু নিউট্রন সংখ্যা ভিন্ন, তাদেরকে আইসোটোপ বলা হয়।
নিউট্রন সংখ্যা ভিন্ন হওয়ার কারণে একই মোলের বিভিন্ন আইসোটোপের ভর সংখ্যা ভিন্ন ভিন্ন হয়।
অর্থাৎ আইসোটোপ বলতে এমন পরমাণুকে বোঝায় যারা একই পরমাণবিক সংখ্যা কিন্তু ভিন্ন ভর সংখ্যা বহন করে। একটি সাধারণ উদাহরণ হিসেবে আমরা হাইড্রোজেনের আইসোটোপগুলো বিবেচনা করতে পারি।
হাইড্রোজেনের তিনটি প্রধান আইসোটোপ রয়েছে:
1. প্রোটিয়াম (1H) - এটি সবচেয়ে সাধারণ হাইড্রোজেন আইসোটোপ, যার ভর সংখ্যা 1।
2. ডিউটেরিয়াম (2H) - এটিতে 1টি নিউট্রন রয়েছে, ভর সংখ্যা 2।
3. ট্রিটিয়াম (3H) - এটিতে 2টি নিউট্রন রয়েছে, ভর সংখ্যা 3।
উপরের তিনটি আইসোটোপের পরমাণবিক সংখ্যা এক (হাইড্রোজেনের পরমাণবিক সংখ্যা 1), কিন্তু ভর সংখ্যা আলাদা। ফলে এগুলো হাইড্রোজেনের আইসোটোপ। এইরকম আরো অনেক পরমাণুর আইসোটোপ রয়েছে যারা একই পরমাণবিক সংখ্যা কিন্তু ভিন্ন ভর সংখ্যা বহন করে।
এখানে আইসোটোপগুলির ভরকে A এবং পারমাণবিক সংখ্যাকে Z প্রতীক দিয়ে বুঝানো হয়েছে।
অনেক সময় শুধু ভর সংখ্যা দিয়েই আইসোটোপ নির্দেশ করা হয়। যেমন Carbon 13, Carbon 12।
1. হাইড্রোজেনের আইসোটোপ:
2. কার্বনের আইসোটোপ:
3. অক্সিজেনের আইসোটোপ:
4. ইউরেনিয়ামের আইসোটোপ:
5. লিথিয়ামের আইসোটোপ:
এগুলো কয়েকটি উদাহরণ যা আইসোটোপের ধারণা স্পষ্ট করে।
কয়েকটি স্থায়ী আইসোটোপের উদাহরণ:
পৃথিবীতে সবচেয়ে বেশি স্থায়ী আইসোটোপ পাওয়া যায়। এগুলো অসীম সময় ধরে অপরিবর্তিত থাকে।
এসব আইসোটোপ অস্থিতিশীল এবং সময়ের সাথে সাথে নিজের মধ্যে পরিবর্তন হয়ে অন্য তত্ত্বে রূপান্তরিত হয়।
কয়েকটি রেডিও আইসোটোপের উদাহরণ:
এছাড়াও আরো অনেক রেডিওআইসোটোপ রয়েছে যা বিভিন্ন খাতে ব্যবহার হয়।
আইসোটোপগুলোর পরমাণবিক সংখ্যা (প্রোটন ও নিউট্রনের সংখ্যা) একই হলেও তাদের ভর সংখ্যা (মাত্র নিউট্রন সংখ্যা) পারস্পরিক ভিন্ন হয়।
২. রাসায়নিক ধর্ম একই থাকে:
একই তত্ত্বের আইসোটোপগুলোর রাসায়নিক বৈশিষ্ট্য একই থাকে। তাদের রাসায়নিক বন্ধন এবং রিয়াকশনগুলো একে অপরের সমান।
৩. ভৌতিক বৈশিষ্ট্য পার্থক্য:
ভিন্ন ভর সংখ্যার কারণে আইসোটোপগুলোর ভৌতিক ও পরমাণু বৈশিষ্ট্য পারস্পরিক পার্থক্য বহন করে। যেমন - ভর, ঘনত্ব, গলনাঙ্ক, স্ফুটনাঙ্ক প্রভৃতি ভৌত ধর্মগুলি পৃথক হয়।
৪. পরমাণুর স্থিতিশীলতা ভিন্ন:
নিউট্রনের সংখ্যা বেড়ে গেলে আইসোটোপগুলো অস্থিতিশীল হয়ে পড়ে। সুতরাং ভিন্ন আইসোটোপের স্থিতিশীলতাও পার্থক্য বহন করে।
আইসোটোপগুলির এই কয়েকটি বৈশিষ্ট্যের কারণেই একই তত্ত্বের আইসোটোপগুলো পরস্পর ভিন্ন হয়ে থাকে।
এসব ধর্ম আইসোটোপকে অন্যান্য পরমাণু থেকে পৃথক করে তুলে ধরে।
১. চিকিৎসা ক্ষেত্রে আইসোটোপের ব্যবহার:
২. খাদ্য শস্যে আইসোটোপ দিয়ে উৎপাদন বৃদ্ধি করা হয়।
৩. পরমাণু রিয়্যাক্টরে ইঞ্জিন হিসেবে আইসোটোপ ব্যবহার হয়।
৪. পরমাণু বোমা তৈরিতে উর্যানিয়ামের আইসোটোপ ব্যবহার হয়।
৫. কার্বন ডেটিং পদ্ধতিতে কার্বনের আইসোটোপ ব্যবহার করা হয়।
৬. পানির উৎস সনাক্তকরণে হাইড্রোজেন ও অক্সিজেনের আইসোটোপ ব্যবহার হয়।
এভাবে বিজ্ঞান, চিকিৎসা, কৃষি, পরমাণু শক্তি ইত্যাদি অনেক ক্ষেত্রে আইসোটোপের বিশাল প্রয়োগ রয়েছে।
উত্তর: একই তত্ত্বের ঐ পরমাণুগুলো যারা পরমাণবিক সংখ্যায় একই কিন্তু ভর সংখ্যায় ভিন্ন।
২. আইসোটোপের কত প্রকার আছে?
উত্তর: দুই প্রকার - স্থিতিশীল ও অস্থিতিশীল আইসোটোপ।
৩. রেডিওআইসোটোপ কি?
উত্তর: যে আইসোটোপগুলো স্বয়ংক্রিয়ভাবে রেডিওধর্মী, তাকে রেডিওআইসোটোপ বলে।
৪. হাইড্রোজেনের আইসোটোপ কি কি?
উত্তর: প্রোটিয়াম, ডিউটেরিয়াম, ট্রিটিয়াম।
৫. স্থায়ী আইসোটোপের উদাহরণ দাও।
উত্তর: কার্বন-12, অক্সিজেন-16, নাইট্রোজেন-14 ইত্যাদি।
৬. আইসোটোপের কী কী ব্যবহার?
উত্তর: চিকিৎসা, কৃষি, পরমাণু শক্তি, কার্বন ডেটিং ইত্যাদি।
৭. আইসোটোপের প্রধান বৈশিষ্ট্য কি কি?
উত্তর: পরমাণবিক সংখ্যা একই কিন্তু ভর সংখ্যা ভিন্ন, রাসায়নিক গুণ একই কিন্তু ভৌতিক গুণ ভিন্ন।
৮. কার্বন-ডেটিং কিভাবে করা হয়?
উত্তর: কার্বন-১৪ আইসোটোপ ব্যবহার করে কার্বন-ডেটিং করা হয়।
৯. MRI কিভাবে কাজ করে?
উত্তর: MRI হাইড্রোজেনের আইসোটোপ ব্যবহার করে কাজ করে।
১০. আইসোটোপের প্রয়োগক্ষেত্র কী কী?
উত্তর: চিকিৎসা, বিজ্ঞান, কৃষি, পরমাণু শক্তি, পরিবেশ নিরীক্ষণ ইত্যাদি।
পর্যায় সারণিতে মৌলসমূহকে পারমাণবিক সংখ্যার ভিত্তিতে স্থান দেয়া হয় বলে কোন মৌলের আইসোটোপসমূহও পর্যায় সারণির একই স্থানে অবস্থান নেয়। বস্তুত: Isotope একটি গ্রীক শব্দ 'Iso' মানে 'একই' এবং 'tope' অর্থাৎ স্থান।
আইসোটোপগুলোর রাসায়নিক বৈশিষ্ট্য এক হলেও তাদের ভৌতিক বৈশিষ্ট্য পরস্পর ভিন্ন থাকে। আজকের আমাদের আলোচনায় আমরা আইসোটোপ সম্পর্কে বিস্তারিত জেনে নেব। আশা করি এই পোস্ট আপনাদের উপকারী হবে।
আইসোটোপ কাকে বলে :-
যে সকল পরমাণুর পারমাণবিক সংখ্যা এক কিন্তু ভর সংখ্যা ভিন্ন তাদেরকে আইসোটপ বলা হয়।মৌলের পারমাণবিক সংখ্যা (Z.) মৌলের প্রোটন এবং ইলেকট্রন সংখ্যা নির্দেশ করে। পরমাণুর ভর সংখ্যা (A) থেকে পারমাণবিক সংখ্যা (Z) বিয়োগ করা হলে পরমাণুর নিউট্রন সংখ্যা পাওয়া যায়। কোন মৌলের একাধিক পরমাণু যাদের পারমাণবিক সংখ্যা এক কিন্তু নিউট্রন সংখ্যা ভিন্ন, তাদেরকে আইসোটোপ বলা হয়।
নিউট্রন সংখ্যা ভিন্ন হওয়ার কারণে একই মোলের বিভিন্ন আইসোটোপের ভর সংখ্যা ভিন্ন ভিন্ন হয়।
অর্থাৎ আইসোটোপ বলতে এমন পরমাণুকে বোঝায় যারা একই পরমাণবিক সংখ্যা কিন্তু ভিন্ন ভর সংখ্যা বহন করে। একটি সাধারণ উদাহরণ হিসেবে আমরা হাইড্রোজেনের আইসোটোপগুলো বিবেচনা করতে পারি।
হাইড্রোজেনের তিনটি প্রধান আইসোটোপ রয়েছে:
1. প্রোটিয়াম (1H) - এটি সবচেয়ে সাধারণ হাইড্রোজেন আইসোটোপ, যার ভর সংখ্যা 1।
2. ডিউটেরিয়াম (2H) - এটিতে 1টি নিউট্রন রয়েছে, ভর সংখ্যা 2।
3. ট্রিটিয়াম (3H) - এটিতে 2টি নিউট্রন রয়েছে, ভর সংখ্যা 3।
উপরের তিনটি আইসোটোপের পরমাণবিক সংখ্যা এক (হাইড্রোজেনের পরমাণবিক সংখ্যা 1), কিন্তু ভর সংখ্যা আলাদা। ফলে এগুলো হাইড্রোজেনের আইসোটোপ। এইরকম আরো অনেক পরমাণুর আইসোটোপ রয়েছে যারা একই পরমাণবিক সংখ্যা কিন্তু ভিন্ন ভর সংখ্যা বহন করে।
এখানে আইসোটোপগুলির ভরকে A এবং পারমাণবিক সংখ্যাকে Z প্রতীক দিয়ে বুঝানো হয়েছে।
অনেক সময় শুধু ভর সংখ্যা দিয়েই আইসোটোপ নির্দেশ করা হয়। যেমন Carbon 13, Carbon 12।
আইসোটোপ এর উদাহরণ দাও :-
আইসোটোপের কিছু উদাহরণ:1. হাইড্রোজেনের আইসোটোপ:
- - প্রোটিয়াম (1H)
- - ডিউটেরিয়াম (2H)
- - ট্রিটিয়াম (3H)
2. কার্বনের আইসোটোপ:
- - কার্বন-12 (12C)
- - কার্বন-13 (13C)
- - কার্বন-14 (14C)
3. অক্সিজেনের আইসোটোপ:
- - অক্সিজেন-16 (16O)
- - অক্সিজেন-17 (17O)
- - অক্সিজেন-18 (18O)
4. ইউরেনিয়ামের আইসোটোপ:
- - ইউরেনিয়াম-238 (238U)
- - ইউরেনিয়াম-235 (235U)
- - ইউরেনিয়াম-234 (234U)
5. লিথিয়ামের আইসোটোপ:
- - লিথিয়াম-6 (6Li)
- - লিথিয়াম-7 (7Li)
এগুলো কয়েকটি উদাহরণ যা আইসোটোপের ধারণা স্পষ্ট করে।
আইসোটোপ কত প্রকার ও কি কি :-
আইসোটোপ মূলত দুই প্রকারের:- স্থায়ী আইসোটোপ (Stable Isotopes)
- অস্থায়ী আইসোটোপ (Unstable Isotopes) বা রেডিও আইসোটোপ।
স্থায়ী আইসোটোপ কাকে বলে :-
যে আইসোটোপগুলো স্বাভাবিকভাবে অবিকৃত অবস্থায় থাকে এবং রেডিওসক্রিয় নয়, তাকে স্থায়ী আইসোটোপ বলে। এসব আইসোটোপের কোন স্বয়ংক্রিয় পরিবর্তন ঘটে না।কয়েকটি স্থায়ী আইসোটোপের উদাহরণ:
- - হাইড্রোজেন-1 (প্রোটিয়াম)
- - কার্বন-12
- - নাইট্রোজেন-14
- - অক্সিজেন-16
- - সালফার-32
- - ক্লোরিন-35
- - পোট্যাশিয়াম-39
পৃথিবীতে সবচেয়ে বেশি স্থায়ী আইসোটোপ পাওয়া যায়। এগুলো অসীম সময় ধরে অপরিবর্তিত থাকে।
রেডিও আইসোটোপ কাকে বলে :-
যে আইসোটোপগুলো স্বয়ংক্রিয়ভাবে রেডিওসক্রিয় বিকিরণ প্রদান করে তাকে রেডিও আইসোটোপ বলে।এসব আইসোটোপ অস্থিতিশীল এবং সময়ের সাথে সাথে নিজের মধ্যে পরিবর্তন হয়ে অন্য তত্ত্বে রূপান্তরিত হয়।
কয়েকটি রেডিও আইসোটোপের উদাহরণ:
- - কার্বন-14 (14C) - কার্বন ডেটিং-এ ব্যবহৃত হয়।
- - ফসফরাস-32 (32P) - চিকিৎসায় ব্যবহার হয়।
- - সোডিয়াম-24 (24Na) - হৃদরোগ নির্ণয়ে ব্যবহার করা হয়।
- - কোবাল্ট-60 (60Co) - ক্যানসার চিকিৎসায় ব্যবহৃত হয়।
- - ইউরেনিয়াম-235 (235U) - পরমাণু শক্তি উৎপাদনে ব্যবহার হয়।
এছাড়াও আরো অনেক রেডিওআইসোটোপ রয়েছে যা বিভিন্ন খাতে ব্যবহার হয়।
আইসোটোপের বৈশিষ্ট্য :-
১. পরমাণবিক সংখ্যা একই থাকলেও ভর সংখ্যা ভিন্ন হয়:আইসোটোপগুলোর পরমাণবিক সংখ্যা (প্রোটন ও নিউট্রনের সংখ্যা) একই হলেও তাদের ভর সংখ্যা (মাত্র নিউট্রন সংখ্যা) পারস্পরিক ভিন্ন হয়।
২. রাসায়নিক ধর্ম একই থাকে:
একই তত্ত্বের আইসোটোপগুলোর রাসায়নিক বৈশিষ্ট্য একই থাকে। তাদের রাসায়নিক বন্ধন এবং রিয়াকশনগুলো একে অপরের সমান।
৩. ভৌতিক বৈশিষ্ট্য পার্থক্য:
ভিন্ন ভর সংখ্যার কারণে আইসোটোপগুলোর ভৌতিক ও পরমাণু বৈশিষ্ট্য পারস্পরিক পার্থক্য বহন করে। যেমন - ভর, ঘনত্ব, গলনাঙ্ক, স্ফুটনাঙ্ক প্রভৃতি ভৌত ধর্মগুলি পৃথক হয়।
৪. পরমাণুর স্থিতিশীলতা ভিন্ন:
নিউট্রনের সংখ্যা বেড়ে গেলে আইসোটোপগুলো অস্থিতিশীল হয়ে পড়ে। সুতরাং ভিন্ন আইসোটোপের স্থিতিশীলতাও পার্থক্য বহন করে।
আইসোটোপগুলির এই কয়েকটি বৈশিষ্ট্যের কারণেই একই তত্ত্বের আইসোটোপগুলো পরস্পর ভিন্ন হয়ে থাকে।
আইসোটোপের ধর্ম :-
আইসোটোপের প্রধান ধর্ম নিম্নে বর্ণিত:- - একই তত্ত্বের আইসোটোপ সমূহের পরমাণবিক সংখ্যা একই থাকে কিন্তু ভর সংখ্যা ভিন্ন থাকে।
- - আইসোটোপগুলোর রাসায়নিক গুণ একই হলেও ভৌতিক ও পরমাণু গুণে পার্থক্য রয়েছে।
- - নিউট্রনের সংখ্যা বেড়ে গেলে আইসোটোপগুলো অস্থিতিশীল হয়ে পড়ে।
- - ভিন্ন আইসোটোপের পরমাণু মাত্রাও পার্থক্য বহন করে।
- - আইসোটোপ সমূহ রেডিওধর্মী হওয়ার প্রবণতাও ভিন্ন হয়।
- - আইসোটোপ পরস্পর রূপান্তরযোগ্য নয়।
এসব ধর্ম আইসোটোপকে অন্যান্য পরমাণু থেকে পৃথক করে তুলে ধরে।
আইসোটোপের ব্যবহার :-
আইসোটোপের বিভিন্ন ক্ষেত্রে ব্যবহার হয়, যেমন:১. চিকিৎসা ক্ষেত্রে আইসোটোপের ব্যবহার:
- - রেডিওআইসোটোপ দিয়ে ক্যানসার চিকিৎসায় ব্যবহার হয়।
- - MRI স্ক্যানে হাইড্রোজেনের আইসোটোপ ব্যবহার হয়।
২. খাদ্য শস্যে আইসোটোপ দিয়ে উৎপাদন বৃদ্ধি করা হয়।
৩. পরমাণু রিয়্যাক্টরে ইঞ্জিন হিসেবে আইসোটোপ ব্যবহার হয়।
৪. পরমাণু বোমা তৈরিতে উর্যানিয়ামের আইসোটোপ ব্যবহার হয়।
৫. কার্বন ডেটিং পদ্ধতিতে কার্বনের আইসোটোপ ব্যবহার করা হয়।
৬. পানির উৎস সনাক্তকরণে হাইড্রোজেন ও অক্সিজেনের আইসোটোপ ব্যবহার হয়।
এভাবে বিজ্ঞান, চিকিৎসা, কৃষি, পরমাণু শক্তি ইত্যাদি অনেক ক্ষেত্রে আইসোটোপের বিশাল প্রয়োগ রয়েছে।
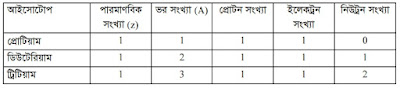
বিভিন্ন মৌলের আইসোটোপ সংখ্যা :-
নীচের টেবিলে বিভিন্ন মৌলের আইসোটোপ সংখ্যা ও তাদের ভর সংখ্যা তুলে ধরা হয়েছে। এর মাধ্যমে আইসোটোপ সংখ্যার পার্থক্য স্পষ্টভাবে দেখা যাচ্ছে।আইসোটোপ সম্পর্কিত প্রশ্নত্তর:-
১. আইসোটোপ কী?উত্তর: একই তত্ত্বের ঐ পরমাণুগুলো যারা পরমাণবিক সংখ্যায় একই কিন্তু ভর সংখ্যায় ভিন্ন।
২. আইসোটোপের কত প্রকার আছে?
উত্তর: দুই প্রকার - স্থিতিশীল ও অস্থিতিশীল আইসোটোপ।
৩. রেডিওআইসোটোপ কি?
উত্তর: যে আইসোটোপগুলো স্বয়ংক্রিয়ভাবে রেডিওধর্মী, তাকে রেডিওআইসোটোপ বলে।
৪. হাইড্রোজেনের আইসোটোপ কি কি?
উত্তর: প্রোটিয়াম, ডিউটেরিয়াম, ট্রিটিয়াম।
৫. স্থায়ী আইসোটোপের উদাহরণ দাও।
উত্তর: কার্বন-12, অক্সিজেন-16, নাইট্রোজেন-14 ইত্যাদি।
৬. আইসোটোপের কী কী ব্যবহার?
উত্তর: চিকিৎসা, কৃষি, পরমাণু শক্তি, কার্বন ডেটিং ইত্যাদি।
৭. আইসোটোপের প্রধান বৈশিষ্ট্য কি কি?
উত্তর: পরমাণবিক সংখ্যা একই কিন্তু ভর সংখ্যা ভিন্ন, রাসায়নিক গুণ একই কিন্তু ভৌতিক গুণ ভিন্ন।
৮. কার্বন-ডেটিং কিভাবে করা হয়?
উত্তর: কার্বন-১৪ আইসোটোপ ব্যবহার করে কার্বন-ডেটিং করা হয়।
৯. MRI কিভাবে কাজ করে?
উত্তর: MRI হাইড্রোজেনের আইসোটোপ ব্যবহার করে কাজ করে।
১০. আইসোটোপের প্রয়োগক্ষেত্র কী কী?
উত্তর: চিকিৎসা, বিজ্ঞান, কৃষি, পরমাণু শক্তি, পরিবেশ নিরীক্ষণ ইত্যাদি।







0 মন্তব্যসমূহ
Please do not enter any spam link in the comment box.